α-突触核蛋白与帕金森氏症
帕金森氏症 (PD) 是一种神经衰退疾病���,该疾病患者的大脑中可见α-突触核蛋白聚集形成路易体����。α-突触核蛋白是由SNCA基因表达的一种分子量为 14-kDa 的蛋白����。目前已知的α-突触核蛋白的自然状态可有很多种��:可能是没有折叠的单体����、折叠的四聚体���、或者是处于和其他寡聚体动态共存的形式���。在帕金森疾病中����,这些分子量小的α-突触核蛋白会聚集形成原纤维��、纤维以及路易体��,从而导致神经元的病变和死亡����。也有其他研究表明寡聚体和原纤维具有神经毒性3-6而路易小体可能有神经保护功能�����。
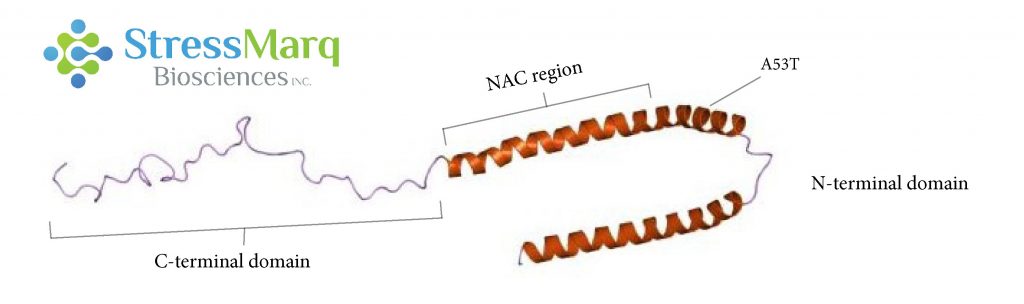 |
| α-突触核蛋白由三个主要区域��:羧基末端区域���、NAC区域���、以及氨基末端区域�����。A53T 突变位于氨基末端区域����。 |
什么是 A53T 突变?
A53T 是错义点突变, 也就是导致了氨基酸的改变����:第53 个氨基酸由丙氨酸突变为苏氨酸��。该突变是由于SNCA基因 209位置的鸟嘌呤变成了腺嘌呤 (G209A)����。
A53T 突变在帕金森疾病中的影响?
A53T 突变与一种常染色体显性遗传的早发型 PD 相关���,这种 PD 最先发现于意大利和希腊裔家族�����,也见于一个韩国裔家族��。 A53T 变异导致该疾病的发病年龄比较早����。虽然大部分的 PD 病例是散发型的����,并非遗传病�����,而且也不涉及 A53T 突变, 但是研究 A53T 突变可以帮助科研学者们更好的了解α-突触核蛋白的聚集和发展机制���,从而研发出更好的疾病模型和治疗方案�����。
A53T 聚集
A53T 突变型α-突触核蛋白在溶液中聚集速度要比野生型 (WT) 要快��。该突变对于α-突触核蛋白纤维原形成速率的影响比对纤维增长的影响要大�����。A53T 和 A30P 突变都与早发型 PD 相关并且促进纤维原的形成���,说明纤维原促进了PD 中所见的神经衰退���。
为什么 A53T 突变型 α-突触核蛋白的聚集纤维原化要比 WT 的 α-突触核蛋白快?
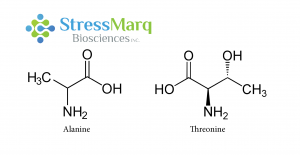 |
| 丙氨酸和苏氨酸有相似的结构��,但是α-突触核蛋白中的丙氨酸替换成苏氨酸对α突触核蛋白的纤维原聚集有很大的作用���。 |
A53T 变异只涉及到单一氨基酸改变���,而且丙氨酸和苏氨酸结构上非常相近���,那么为什么A53T突变型有这么强的聚集效果呢����?A53T 和其他致病突变都发生在α-突触核蛋白的氨基末端��。理论模型显示 A53T 突变会使α-突触核蛋白的 NAC 区域和氨基或羧基区域的长程相互作用消失���,导致 beta折叠的加速形成��。NMR 测量数据显示 A53T 突变可以延长并稳定在寡聚化和纤维化中起着重要作用的 beta折叠结构�����。
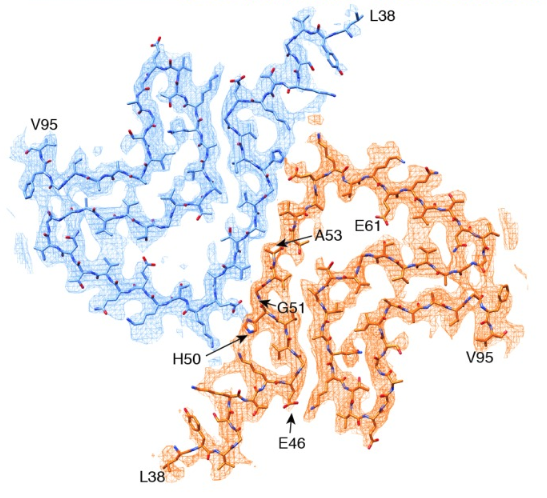 |
| α-突触核蛋白的冷冻电镜结构显示致病基因突变位于两个纤维原丝的交界面��。图片来源��: doi.org/10.7554/eLife.36402.001 © 2018, Guerrero-Ferreira et al |
冷冻电镜分析显示α-突触核蛋白纤维由两个纤维原丝左旋螺旋而成����。A53T 突变和其他四种早老型 PD 突变都位于两个纤维原丝的交界面���。带有亲水基的苏氨酸的加入打破了这种“立体拉链式交界面”致使纤维结构的改变�����。
A53T 突变的影响
不论A53T 突变型 α-突触核蛋白的聚集机制是怎样的���,它都造成了毁灭性的下游效应����。A53T 突变型α-突触核蛋白在小鼠中的表达导致了运动缺陷���,麻痹和死亡���。A53T 突变型 α-突触核蛋白比 WT α-突触核蛋白更倾向于形成环形的和管状的纤维原����,并且A53T 突变型α-突触核蛋白纤维原与磷脂膜泡紧密结合���,从而使通透性增加���。这些脂质膜泡可以通过促进单体的集结成核作用来诱导纤维的生成��。A53T 突变被认为是通过改变小泡孔的结构或者是通过促进通透化纤维原形成来促进了纤维的形成��。
多巴胺
多巴胺是一种调节语言和运动的神经递质��。帕金森氏症的运动缺陷是由于分泌多巴胺的神经元缺失引起的���。Mice overexpressing 过度表达 A53T 突变型 α-突触核蛋白的小鼠在发生神经衰退前经历了多巴胺信号传导受损����,表达 A53T 突变型 α-突触核蛋白的大鼠比表达 WT α-突触核蛋白的对照组大鼠展现出了更严重的多巴胺分泌神经缺失����。A53T 突变型α-突触核蛋白的表达也被认为会使细胞更容易受到多巴胺毒性的攻击��。
突触
突触是是神经元的构成部分���,通过突触小泡在神经元间传递信号���。 A53T 突变型和 WT 型 α-突触核蛋白都可以通过耗尽突触小泡的回收池来抑制突触前体的信号传导���。A53T α-突触核蛋白的表达也会造成突触后赤字(突触后信号缺失)���。这种突触后赤字是由tau的高度磷酸化和它在树突棘的错误分布引起的���。
小胶质细胞
小胶质细胞负责突触修剪还负责通过产生炎症介质来对损伤做出反应�����。被激活的小胶质细胞会改变形态�����,产生活性氧 (ROS), 并释放炎症细胞因子�����。在帕金森疾病中��,小胶质细胞可能会被过度激活并导致多巴胺分泌神经的缺失��。A53T α-突触核蛋白激活小胶质细胞的能力比 WT 型和其他突变型都要强��,引起小胶质细胞增生以及接下来的炎症反应����。A53T α-突触核蛋白的表达也是细胞更容易受到氧化应激的损害����。
星形胶质细胞
当A53T 突变型α-突触核蛋白在小鼠星形胶质细胞中选择性表达时����,迅速导致了麻痹���。这被认为是由于该A53T突变型在星形胶质细胞中的表达减少了谷氨酸转运体的表达而且导致小胶质细胞的激活��。
线粒体功能障碍以及内质网应激
A53T 突变型 α-突触核蛋白诱发的炎症和氧化应激既影响线粒体也影响内质网 (ER)����。A53T 突变型的表达引起的线粒体功能障碍涉及到受损的线粒体膜电位和呼吸机能���。这接下来就导致线粒体的自噬31���。过度激活的自噬反应可能引起线粒体缺失从而导致神经衰退���。然而自噬反应会清除一些聚集的蛋白从而起到一定程度的保护作用����。A53T 突变型神经元显示出线粒体移动性的受损���,可以使用雷帕霉素(一种自噬诱导剂)来逆向恢复���。
在分化的 PC12 细胞中, A53T 突变型 α-突触核蛋白表达的增加可导致细胞死亡率升高 40%���,这主要是由于细胞内的ROS水平升高而且蛋白酶体活性又降低��。在这种情况下�����,ER应激和线粒体功能的障碍(包括释放线粒体细胞色素C以及caspase-3, -9, 和 -12的活性增强)����,导致了细胞死亡��。
潜在治疗方案
预防与 A53T 突变相关的神经衰退可能是潜在的 PD 治疗方案���。一种COX-1 抑制剂延长了表达A53T 突变型 α-突触核蛋白的小鼠的寿命���,环孢菌素A, Z-Vad, 和 Caspase-3 以及 -9 抑制剂减少了ER和线粒体应激导致的细胞死亡�����。虽然 A53T 突变只占 PD 病例中的少数����,WT α-突触核蛋白可能依然有类似的较低程度的纤维化机制和神经衰退进程��。A53T 突变型α-突触核蛋白比 WT 型更容易在大鼠中建立早发型 PD 模型���。更多的了解 A53T α-突触核蛋白纤维聚集并抑制发病机制可以帮助推进 A53T 突变型 PD的疾病治疗方案����,同时对其他类型的 PD 也有参考作用����。
更多详情请咨询Stressmarq优势代理商-欣博盛生物
全国服务热线: 4006-800-892 邮箱: market@hnyazd.com
深圳: 0755-26755892 北京: 010-88594029
上海: 021-34613729 广州: 020-87615159
代理品牌网站: www.hnyazd.com
自主品牌网站: www.neobiosescience.net